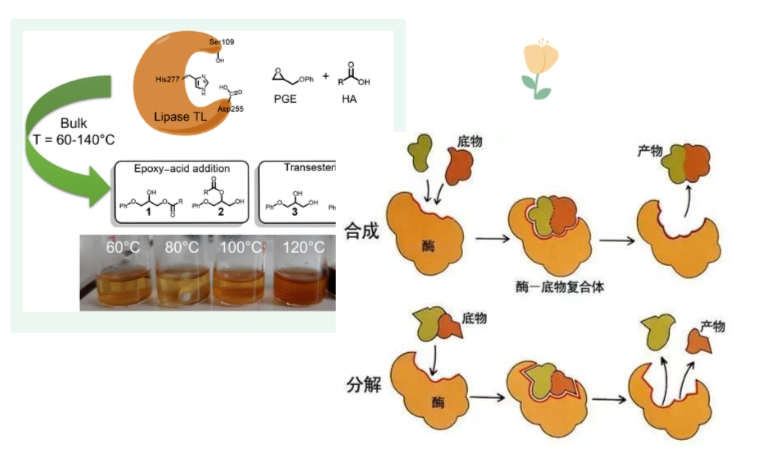
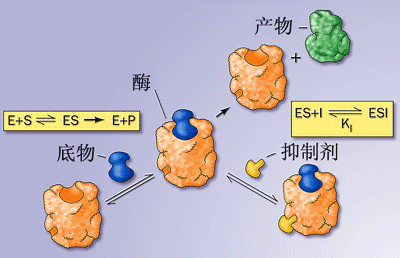
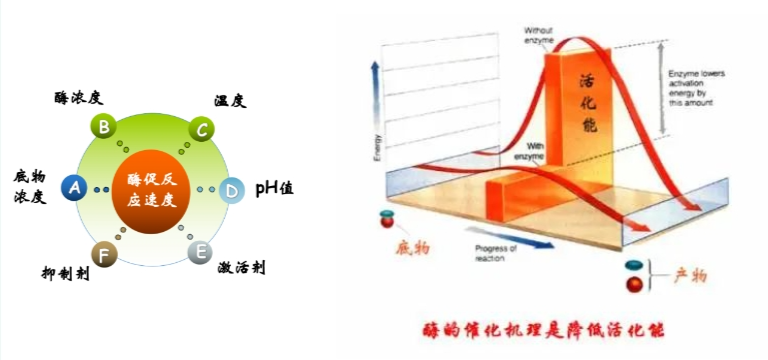
生命的重要特征是自我复制和新陈代谢,这种复杂生物化学变化是由数千种酶所催化的。
蛋白质是生命的体现者,而蛋白质(包括酶)是由活细胞中DNA作为基因信息载体,通过mRNA作为模板、rRNA、 tRNA、ATP、辅助因子及酶的作用下合成的。
因此,了解酶的生物机理,对于开发新酶源、酶学的研究及应用,甚至服用或使用酶制剂的群体都具有重要的指导意义。
回归主题,前几期我们介绍了酶的重要性,简析了酶的分类,也知道了现阶段已发现7000多种酶,那么如繁星般璀璨的enzyme是否具有共性呢?它们和普通催化剂到底有什么区别?
酶的催化特性
酶是生物催化剂,是特殊的蛋白质,这两句话说完整就是“酶是具有特殊催化功能的蛋白质”。
像普通化学催化剂一样,少量的酶就可以极大地加速催化反应,而酶本身在反应前后不发生变化。
化学反应的速度可以代表酶的催化效率,以单位时间内每克分子酶所转化的分子数来表示,也可以用催化生成物质的重量比来表示。但是,酶与化学催化剂相比还有许多不同之处。
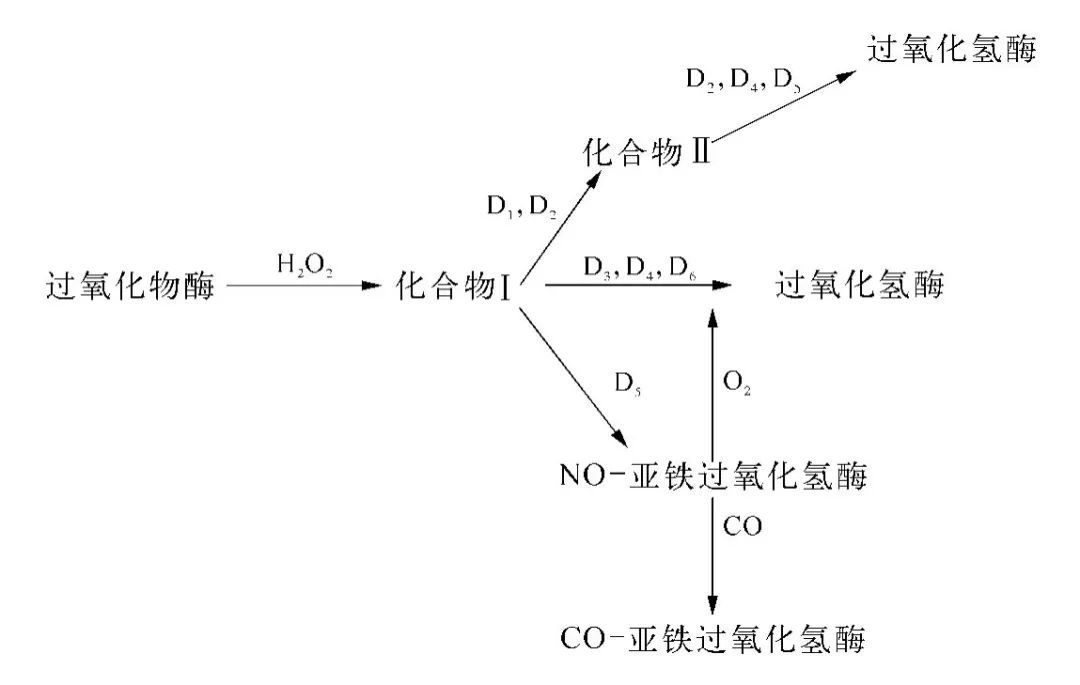
过氧化氢酶的催化效率比一般非生物催化剂高一千万倍;蔗糖酶把蔗糖分解成葡萄糖和果糖,比强酸高两千亿倍,所以在细胞里的酶数量虽然不多,但催化效率却极高。
专一性强
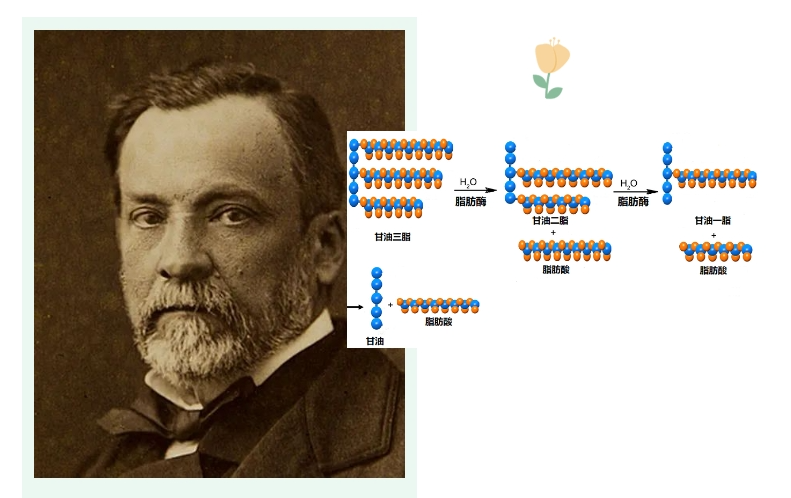
1858年巴斯德发现,一种霉菌能发酵右旋酒石酸,它对左旋酒石酸没有任何作用,这是第一次发现酶的催化作用具有高度专一性。
说的再简单些,多数酶只对特定物质有催化功能,针对性强。
有些酶的专一性是绝对的,如尿素酶,它只能把尿素分解成为氨和二氧化碳,除此之外对任何物质都不起作用。
脂肪酶是专门用来脂肪分解的,它会产生相应的脂肪酸和醇的酶。它的作用范围虽然较广,但也绝不能分解非脂肪物质。
为什么酶的催化作用具有高度的专一性呢?催化效率又为什么那么高?
关于酶的专一性有许多学说,获得广泛支持的有“锁钥学说”、“诱导契合学说”、还有“过渡态学说”。
这些学说都有共同点,即酶的专一性必须通过和底物结合才会表现出来。
下面小编来简单介绍一下三种学说。
锁钥学说
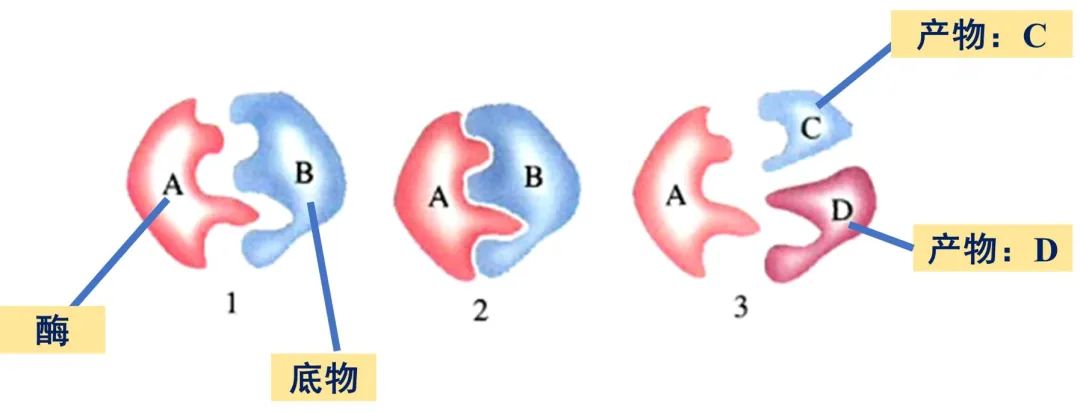
1894年,德国有机化学家菲谢尔(E. Fisher)提出了“酶与底物”的锁钥学说来解释专一性。
这种学说认为,在底物分子之间,有一块特别的空隙,恰好和酶蛋白质分子的形状匹配,使底物与酶先结合起来,形成一种中间体。
你可以理解成钥匙和锁芯,只有严丝合缝的结合在一起,才能发挥出如此专一特性。
由于不同底物有不同形状的空隙,因此催化不同底物的酶也就互不相同。
锁钥学说获得相当多的事实支持,事实也的确如此,现代科学发现,底物分子间有一段严格的距离,胆碱和酰基间多一个或少一个都不行,可见距离把控多严谨。
而拥有这种情况的化合物都能和酶发生作用,或者被酶催化水解,或者抑制酶。
锁钥学说的缺点在于它认为酶的结构是刚性的,若如此,就难以解释一个酶可以催化正逆两个反应,因产正逆两个反应底物的分子间隙完全不同。
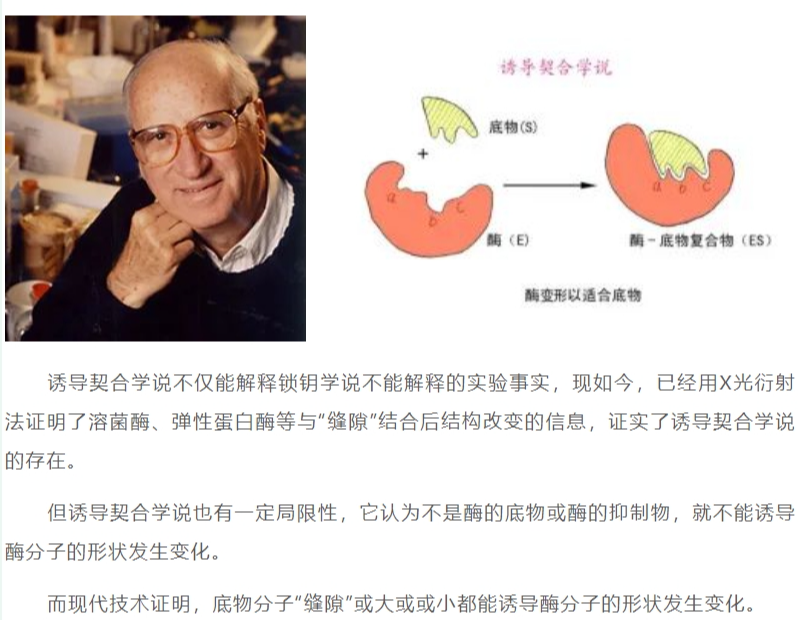
诱导契合学说
这个学说是科什兰(Koshland)于1958年提出的。他的观点是底物分子间的缝隙,和酶分子(包括辅酶)不一定吻合,只有底物分子与酶分子相碰时,会使酶分子形状改变,和“缝隙”形状达成一致。
最后结合成中间体,再进而一系列催化反应。
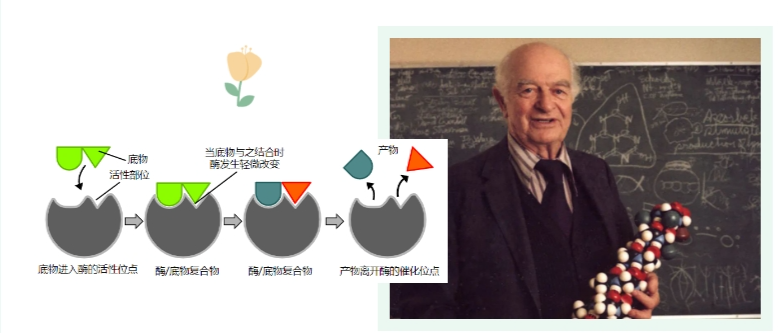
过渡态学说
这种学说认为,酶的专一性既和酶同底物结合有关,也和酶对底物的催化有关。
酶与底物的结合不仅促成了底物分子和酶蛋白分子的正确“配队”,同时也为下一步酶对底物的催化做了准备。
简言之过渡态学说认为,A物质反应成B物质的过程中,存在一种中间状态,非A也非B,这种状态称为“过渡态”。
鲍林(Pauling)的过渡态理论认为酶与底物的过渡态互补,非常有亲和力,能轻易跨过分子间壁垒,也能促使酶反应大大加速。
从上世纪70年代以来,人们开始研究酶作用的过渡态问题。通过研究发现,这些过渡态物质与酶的结合比底物与酶的结合紧密10—100倍,从而证明了酶与底物过渡态互补的概念是正确的。
其实过渡态学说涵盖了专一性的问题,同时对高效性机制也解释了。
反应条件温和
酶能在常温和pH值近乎中性的条件下发挥其催化作用。
一般的化学催化剂常常需要高温、高压、强酸、强碱等剧烈条件,有趣的是,在这样的条件下酶不仅不能起到催化作用,反而会遭受破坏,完全丧失催化能力。
酶促反应过程
要想使蔗糖水解,就需给蔗糖分子较高的能量。
如果用酶做为催化剂,酶与蔗糖先形成中间体,分解反应分成两步进行,结果每步所需要的能量都比一步分解反应要少,所以几乎所有酶促反应都能更快速地进行。
实验室数据指出,蔗糖水解过程中,以无机酸做催化剂,每克分子反应的活化能为25600卡。而用蔗糖酶做催化剂则为11,000卡。
除蔗糖酶外,学者专家们还发现一些酶和底物在催化作用过程中先形成中间体。比如过氧化氢酶催化分解过氧化氢时先形成过氧化氢和过氧化氢酶中间体。
在缺乏镁离子的情况下,核糖核酸酶水解核糖核酸时,观察到酶先吸附在核糖核酸链上,生成对应的中间体。
由此可见,酶促反应是酶先和底物形成中间体,然后酶又以原来的形式释放出来,最终催化完成。
很明显,酶促反应是因为酶降低了反应所需要的活化能,所以使反应更容易进行。
除了以上四点,酶还有多样性、易变性、活性可调节性等特点,篇幅关系本期先科普到这里,酶的其他特性我们有机会再谈。